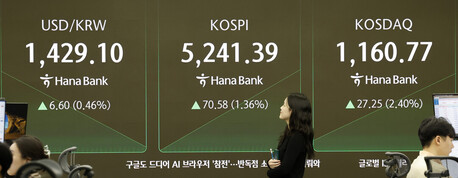
임상 착수 통해 국내 생산 체계 구축 추진
백신 개발 전문 기업 셀리드(코스닥 299660)는 신규 코로나19 LP.8.1 변이 백신에 대한 임상시험 계획 승인(IND)을 식품의약품안전처에 신청했다고 6일 공시를 통해 밝혔다.
LP.8.1 변이는 세계보건기구(WHO), 유럽의약청(EMA), 미국 식품의약청(FDA)이 2025~2026절기 대응 변이주로 권고한 바이러스다. LP.8.1 변이를 표적하는 백신은 기존 변이 백신 대비 최근 확산 중인 변이에 대해 우수한 면역 반응을 유도하는 것으로 보고되고 있다. 국내외에서 코로나19 바이러스의 지속적인 순환으로 중증 질환과 사망이 여전히 발생하고 있는 가운데, 전문가들은 신규 변이에 대응하기 위해 매년 백신 업데이트가 필요하다고 강조하고 있다.
셀리드는 LP.8.1 기반 코로나19 백신을 지난해 5월 선제적으로 개발 완료했으며, 자체 GMP 시설에서 생산한 임상 시료를 활용해 품질 시험과 비임상시험을 모두 마쳤다. 이를 바탕으로 이번에 국내 임상시험 계획 승인 신청에 나섰다.
질병관리청은 2025년 8월 LP.8.1 변이 대응 백신 530만 도즈에 대한 조달 계약을 체결한 바 있다. 현재 국내에서 사용 중인 LP.8.1 표적 백신은 전량 수입에 의존하고 있는 상황이다. 셀리드는 지속적인 신규 변이 백신 연구·개발을 통해 향후 국내 생산과 공급이 가능한 국산 코로나19 백신의 상용화를 목표로 하고 있다.
셀리드는 코로나19 LP.8.1 변이 백신의 IND 승인을 받는 즉시 임상시험에 착수해 백신 상용화에 필요한 절차를 신속히 진행할 계획이다.
한편 셀리드는 코로나19 백신 ‘AdCLD-CoV19-1 OMI’의 임상 3상 결과를 올해 상반기 중 발표할 예정이며, 결과에 따라 식품의약품안전처에 품목 허가를 신청할 방침이다.
강창율 셀리드 대표이사는 “이번 IND 신청을 통해 LP.8.1 기반 코로나19 백신의 임상 개발을 차질 없이 추진하는 한편, 당사가 보유한 백신 라이브러리를 활용해 향후 등장할 다양한 변이에 신속히 대응할 수 있는 백신을 지속적으로 개발해 나가겠다”고 말했다.
 |
CWN 신현수 기자
hs.shin.1716@gmail.com
[저작권자ⓒ CWN(CHANGE WITH NEWS). 무단전재-재배포 금지]


























![국민의힘, ‘한동훈 제명’ 후폭풍에 지지율 하락…李 대통령 국정지지도 54.5% [리얼미터]](/news/data/2026/02/02/p1065587075335908_437_h.jpg)